تحقیق پیوند کوالانسی
نچه اتمهای یک مولکول را به هم نگه میدارد، پیوند کوالانسی است، که در آن دو اتم، در الکترونهای پیوندی، شریکند. پیوند یگانه کوالانسی، متشکل از یک جفت الکترون (دارای اسپین مخالف) است، که اوربیتالی از هر دو اتم پیوند شده را اشغال میکند.
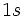 به
طور متقارن دور هسته آن توزیع شده است. وقتی دو اتم هیدروژن یک پیوند
کوالانسی تشکیل میدهند، دو اوربیتال اتمی به نحوی همپوشانی میکنند که
ابرهای الکترونی، در ناحیه بین دو هسته، یکدیگر را تقویت میکنند و احتمال
یافتن الکترون در این ناحیه افزایش مییابد. طبق اصل طرد پائولی دو الکترون
این پیوند باید اسپین مخالف داشته باشند. استحکام پیوند کوالانسی ناشی از
جاذبه متقابل دو هسته مثبت و ابر منفی الکترونهای پیوندی است.
به
طور متقارن دور هسته آن توزیع شده است. وقتی دو اتم هیدروژن یک پیوند
کوالانسی تشکیل میدهند، دو اوربیتال اتمی به نحوی همپوشانی میکنند که
ابرهای الکترونی، در ناحیه بین دو هسته، یکدیگر را تقویت میکنند و احتمال
یافتن الکترون در این ناحیه افزایش مییابد. طبق اصل طرد پائولی دو الکترون
این پیوند باید اسپین مخالف داشته باشند. استحکام پیوند کوالانسی ناشی از
جاذبه متقابل دو هسته مثبت و ابر منفی الکترونهای پیوندی است.
 یا
یا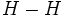 نشان
داد. در ساختار اول، جفت الکترون مشترک با دو نقطه و در ساختار دوم با یک
خط کوتاه نشان داده شده است. این جفت الکترون پیوندی متعلق به کل مولکول
هیدروژن است، ولی میتوان تصور کرد که هر اتم هیدروژن، با دارا شدن دو
الکترون (در تراز
نشان
داد. در ساختار اول، جفت الکترون مشترک با دو نقطه و در ساختار دوم با یک
خط کوتاه نشان داده شده است. این جفت الکترون پیوندی متعلق به کل مولکول
هیدروژن است، ولی میتوان تصور کرد که هر اتم هیدروژن، با دارا شدن دو
الکترون (در تراز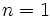 )،
آرایش الکترونی پایدار گاز نجیب هلیم را پیدا کرده است. به عبارت دیگر،
الکترونهای پیوندی دو بار به حساب میآیند، برای هر یک از اتمهای پیونددار
شده یکبار.
)،
آرایش الکترونی پایدار گاز نجیب هلیم را پیدا کرده است. به عبارت دیگر،
الکترونهای پیوندی دو بار به حساب میآیند، برای هر یک از اتمهای پیونددار
شده یکبار.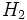 ،
نماینده یک واحد مستقل و مجزا موسوم به مولکول است و گاز هیدروژن متشکل از
مجموعهای از این مولکولهاست. در ترکیبات کاملاً یونی، مولکول وجود ندارد.
فرمول سدیم کلریداست که نشاندهنده سادهترین نسبت کاتیونهای سدیم و
آنیونهای کلرید در بلور سدیم کلرید است (نسبت 1 به 1). فرمولهایی از قبیل
،
نماینده یک واحد مستقل و مجزا موسوم به مولکول است و گاز هیدروژن متشکل از
مجموعهای از این مولکولهاست. در ترکیبات کاملاً یونی، مولکول وجود ندارد.
فرمول سدیم کلریداست که نشاندهنده سادهترین نسبت کاتیونهای سدیم و
آنیونهای کلرید در بلور سدیم کلرید است (نسبت 1 به 1). فرمولهایی از قبیل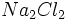 یا
یا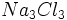 ،
نادرستند، زیرا چنین واحدهای مستقل و مجزایی (چنین مولکولهایی) در بلور
سدیم کلرید وجود ندارند و این فرمولها سادهترین نسبت یونی را نیز بیان
نمیکنند. اما برای مواد کوالانسی فرمولهایی مثل
،
نادرستند، زیرا چنین واحدهای مستقل و مجزایی (چنین مولکولهایی) در بلور
سدیم کلرید وجود ندارند و این فرمولها سادهترین نسبت یونی را نیز بیان
نمیکنند. اما برای مواد کوالانسی فرمولهایی مثل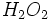 میتواند درست باشد. این فرمول نشانه واحدی مستقل و مجزا (مولکول) است که دو اتم هیدروژن و دو اتم اکسیژن دارد.
میتواند درست باشد. این فرمول نشانه واحدی مستقل و مجزا (مولکول) است که دو اتم هیدروژن و دو اتم اکسیژن دارد.
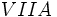 )
هفت الکترون والانس دارد. با تشکیل یک پیوند ساده کوالانسی بین دو تا از
این اتمها، هر اتم به آرایش الکترونی هشتایی، که ویژه گازهای نجیب است،
میرسد. مثلاً در مورد فلوئور،
)
هفت الکترون والانس دارد. با تشکیل یک پیوند ساده کوالانسی بین دو تا از
این اتمها، هر اتم به آرایش الکترونی هشتایی، که ویژه گازهای نجیب است،
میرسد. مثلاً در مورد فلوئور،
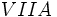 مثل
مثل 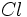 (با هفت الکترون والانس)، برای رسیدن به هشتایی پایدار یک پیوند کوالانسی؛ عناصر
(با هفت الکترون والانس)، برای رسیدن به هشتایی پایدار یک پیوند کوالانسی؛ عناصر 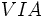 مثل
مثل  و
و 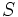 (با شش الکترون والانس) دو پیوند کوالانسی، عناصر
(با شش الکترون والانس) دو پیوند کوالانسی، عناصر 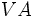 مثل
مثل 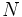 و
و 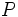 (با پنج الکترون والانس) سه پیوند کوالانسی و عناصر
(با پنج الکترون والانس) سه پیوند کوالانسی و عناصر 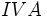 مثل
مثل 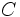 (با چهار الکترون والانس) چهار پیوند کوالانسی بوجود خواهند آورد. ترکیبات هیدروژندار زیر را در نظر بگیرید:
(با چهار الکترون والانس) چهار پیوند کوالانسی بوجود خواهند آورد. ترکیبات هیدروژندار زیر را در نظر بگیرید:

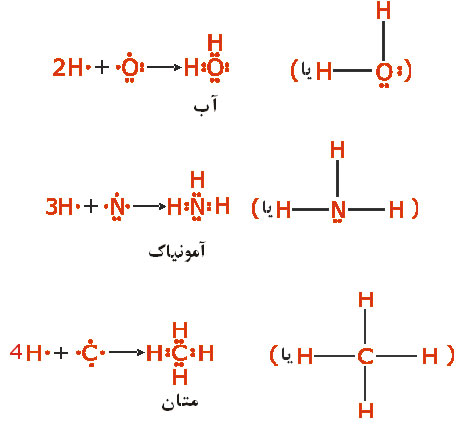
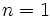 کامل و بقیه اتمها را دارای ساختار هشتایی گاز نجیب دانست.
کامل و بقیه اتمها را دارای ساختار هشتایی گاز نجیب دانست.بررسی پیوند کوالانسی از دیدگاه مکانیک موجی
نظریه پیوند ظرفیت (V . B . T)
جفت الکترون مشترک بين دو هسته يک پيوند کووالانسي تشکيل مي دهند. ميليون ها ماده مرکب شناخته شده فقط از غير فلزات ترکيب يافتهاند. اين مواد مرکب فقط شامل عناصري هستند که در هر اتم 4، 5، 6 يا 7 الکترون والانس دارند. بنابراين الکترون هاي والانس اتمهاي غير فلزي، آنقدر زياد است که اتمها نمي توانند با از دست دادن آن ها ساختار يک گاز نجيب را به دست آورند. معمولا غير فلزات با جفت کردن الکترون ها پيوند ايجاد مي کنند و در اين فرآيند به ساختار يک گاز نجيب مي رسند.
استحکام ترکيب کووالانسي
آن چه اتمهاي يک ملکول را به هم نگه مي دارد، پيوند کووالانسي است، در
تشکيل پيوند کووالانسي الکترون ها، به جاي آن که از اتمي به اتم ديگر
منتقل شوند، ميان دو اتم به اشتراک گذاشته مي شوند. استحکام پيوند
کووالانسي ناشي از جاذبه متقابل دو هسته مثبت و ابر منفي الکترون هاي
پيوندي است. يا به عبارت ديگر مربوط به آن است که هر دو هسته الکترون هاي
مشترکي را جذب مي کنند.
نحوه تشکيل اوربيتال مولکولي
دو اوربيتال به نحوي هم پوشاني مي کنند که ابرهاي الکتروني، در ناحيه بين
دو هسته، يکديگر را تقويت مي کنند و احتمال يافتن الکترون در اين ناحيه
افزايش مي يابد طبق اصل طرد پاولي دو الکترون اين پيوند بايد اسپين مخالف
داشته باشند. در نتيجه تشکيل پيوند اوربيتال هاي اتمي به اوربيتال مولکولي
تبديل مي شود.

انواع ترکيب کووالانسي
ترکيب يگانه کووالانسي: متشکل از يک جفت الکترون(داراي اسپين مخالف) است که اوربيتالي از هر دو اتم پيوند شده را اشغال مي کند. ساده ترين نمونه اشتراک در مولکول هاي دو اتمي گازهايي از قبيل F2، H2 و Cl2 ديده مي شود. اتم هيدروژن فقط يک الکترون دارد هر گاه دو اتم هيدروژن تک الکترون هاي خود را به اشتراک بگذارند، يک جفت الکترون حاصل مي شود. اين جفت الکترون پيوندي متعلق به کل مولکول هيدروژن است و به آرايش الکتروني پايدار گاز نجيب هليم مي رسد. هر الکترون هالوژن، هفت الکترون والانس دارد. با تشکيل يک پيوند کووالانسي بين دو تا از اين اتمها، هر اتم به آرايش الکتروني هشت تايي، که ويژه گازهاي نجيب است، مي رسد.
پيوند چند گانه
بين دو اتم، ممکن است بيش از يک پيوند کووالانسي تشکيل شود در اين موارد
گفته مي شود که اتمها با پيوند چند گانه به هم متصلاند. دو جفت الکترون
مشترک را پيوند دو گانه و سه جفت الکترون مشترک را پيوند سه گانه مي
نامند. اغلب مي توان تعداد پيوندهاي جفت الکتروني را که يک اتم در يک
مولکول بوجود مي آورد از تعداد الکترون هاي مورد نياز براي پر شدن پوسته
والانس آن اتم، پيشبيني کرد. چون براي فلزات شماره گروه در جدول با تعداد
الکترون هاي والانس برابر است، مي توان پيش بيني کرد که عناصر گروه VIIA
مثل Cl(با هفت الکترون والانس)، براي رسيدن به هشت تاي پايدار، يک پيوند
کووالانسي، عناصر گروه VIA مثل O و S(با شش الکترون والانس) دو پيوند
کووالانسي، عناصر VA مثل N و P(با پنج الکترون والانس) سه پيوند کووالانسي و
عناصر گروه IVA مثل C(با چهار الکترون والانس) چهار پيوند کووالانسي به
وجود خواهند آورد.
نماد ساختار مولکول
در ساختار اول، جفت الکترون مشترک با دو نقطه و ساختار دوم با يک خط کوتاه نشان داده شده است.
مانند:
H ― H H :H پيوند يگانه.
Ö: Ö=C=: پيوند دو گانه.
N:N Ξ : پيوند سه گانه.
CΞ :C پيوند چهارگانه.
اگر چه درك ساختار الكتروني از اهميت بسياري برخودار است، با اين حال بيشتر
شيمي دان ها علاقه زيادي به يك اتم تنها ندارند. آن ها به مطالعه گروه هاي
دوتايي يا چند تايي از اتم ها و نيروهايي علاقمند هستند كه آن ها را كنار
هم نگاه مي دارد. نوعي از اين نيرو ها كه پيوند كووالانسي ناميده مي شود،
نيرويي است كه اتم ها را به يكديگر متصل كرده، مولكول ها را بوجود مي آورد.
مطالعه ويژگي هاي اين نوع پيوند ها درك ساختار و رفتار بسياري از مواد
شيميايي را آسان مي كند و پرده از دنياي شگف انگيز مولكول ها بر مي دارد.
مولكول ها و تركيبات كووالانسي
در اين نوع تركيب اتم ها براي پيوند يافتن بر خلاف تركيبات يوني الكترون
ازدست نمي دهند بلكه الكترون هارا ميان خود به اشتراك مي گذارند، در اين
حالت ميان دو اتم پيوندي بوجود مي آيد كه به آن پيوند كووالانسي گفته مي
شود. نيرويي كه دو اتم را در يك پيوند كووالانسي به هم متصل نگه مي دارد،
ممكن است از نيروي موجود ميان يك جفت كاتيون و آنيون بيش تر باشد. آما در
مولكولي مانند مولكول يُد، تنها دو اتم يُد با پيوند كووالانسي به يكديگر
متصل شده اند و با ديگر اتم هاي يد پيوندي ندارند. از آن جايي كه تركيب
هايي مانند يُد اغلب از مولكول هاي جدا از هم تشكيل شده اند آن ها را
تركيبات مولكولي مي نامند. پيوند كووالانسي را مي توان بصورت يك فنر در نظر
گرفت. هنگامي كه دو اتم هيدروژن از يكديگر دور مي شوند، نيروهاي جاذبه
موجود ميان الكترون ها و هسته ها، اين اتم ها را به حالت اول باز مي
گردانند. از سوي ديگر، در اثر نزديك شدن اتم ها به يكديگر، با افزايش
نيروهاي دافعه ميان هسته ها و هم چنين الكترون ها، اتم هاي هيدروژن از
يكديگر دور مي شوند. در واقع اتم هاي هيدروژن در امتداد محور پيوند نوسان
مي كنند، اما نوسانات آن ها به گونه اي است كه همواره هسته ها آن ها را در
يك فاصله تعادلي از يكديگر قرار مي گيرند. به فاصله ي تعادلي ميان هسته هاي
دو اتم درگير در پيوند طول پيوند مي گويند.

ترکيبات يوني
نيروي پيش برنده يک واکنش يوني، جاذبه الکتروستاتيکي متقابل يون هاي ناهمنام است. اين جاذبه باعث آزاد شدن انرژي شبکه مي شود. انرژي شبکه، عامل مهمي در تعيين تعداد بار منفي يا مثبتي است که اتم ها به هنگام تشکيل يک بلور يوني مي پذيرند.
نام گذاري ترکيبات يوني
نام گذاري ترکيبات يوني بر قواعدي چند استوار است. ابتدا از کاتيون(يون مثبت) ترکيب نام برده مي شود و آنيون(يون منفي) پس از آن ذکر مي شود.
کاتيون
بيشتر کاتيون ها، يون هاي تک اتمياند که توسط فلزات بوجود مي آيند. اگر فلز تنها يک نوع کاتيون ايجاد کند، نام يون، همانند فلز مربوط است. +Na يون سديم است. يعني فلز سديمي که ابتدا بصورت گازي در آمده است و از سديم يک الکترون با اعمال انرژي يونش گرفته شده است. 2+Mg يون منيزيم است. 3+Al، يون آلومينيوم است. برخي از فلزات بيش از يک نوع کاتيون بوجود مي آورند. در اين گونه موارد، با نشان دادن تعداد بار کاتيون ها در نام شان آن ها را متمايز مي کنيم. بار اين نوع کاتيون ها بصورت ارقام لاتين بعد از نام فارسي عنصر قرار داده مي شود. +Cu، يون مس(I) و 2+Cu، يون مس(II) است. در روشي قديمي تر براي متمايز کردن دو نوع يون بوجود آمده از يک فلز، پسوندي به نام فلز افزوده مي شود. در اين روش، هرگاه نماد فلزي از لاتين مشتق شده باشد، از نام لاتين فلز استفاده مي شود. پسوند"- و" براي يون داراي بار مثبت کمتر و پسوند"- يک" براي يون با بار مثبت بيشتر مورد استفاده قرار ميگيرد. +Cu، يون کوپرو و 2+Cu يون توجه کنيد که در روش بالا تعداد بارها بروشني بيان نمي شود و نيز اين روش براي فلزاتي که بيش از دو نوع کاتيون توليد مي کنند، قابل استفاده نيست.
آنيون
آنيون هاي تکاتمي از اتم فلزات به وجود مي آيند. نام آن ها از طريق حذف بخش آخر نام عنصر و افزودن پسوند"- يد" به باقي مانده به دست مي آيد. -Cl يون کلريد است. 2-O، يون اکسيد است. 3-N يون نيتريد است. اما، تمام آنيون هايي که نام شان به "يد" ختم مي شود تک اتمي نيستند. بلکه معدودي آنيون هاي چند اتمي نيز نام شان با اين پسوند ختم مي شود. مثلا -CN يون سيانيد است. -OH يون هيدروکسيد است. 2-O2 يون پروکسيد است. آنيون هاي چند اتمي بسياري شناخته شدهاند. بعنوان مثال 2-O2 يون پراکسيد، Cr2O7-2 يون کرومات، SO3-2 يون سولفيت و 3-AsO4 يون آرسنات است.
يون چند اتمي
اين يون، يوني است که از چند اتم که با يکدگير پيوند کووالانسي دارند،
بوجود مي آيد. کايتون هاي چند اتمي معدودند و دو نوع نمونه متداول عبارتند
از:
+NH4 يون آمونيوم و 2+Hg2 يون جيوه(I) يا يون مرکورو. يون 2+Hg2 يون جيوه I
ناميده شده است. زيرا مي توان آن را متشکل از دو يون +Hg(که با يکديگر
پيوند کووالانسي دارند) در نظر گرفت.
نام ترکيبات يوني
نام ترکيبات يوني، متشکل از نام کاتيون و پس از آن، نام آنيون(بصورت لغتي جداگانه) است.
Fe2O3: آهن(II) اکسيد يا فريک اسيد.
PbCO3: سرب(II) کربنات يا پلمبوکربنات.
NH4)2S): آمونيوم سولفيد.
Mg)NO3)2: منيزيم نيترات.
Cu(CN)2: مس(II) سيانيد يا کوپريک سيانيد.
پيوند يوني
پيوند يوني جاذبهاي است که بين يون هاي مثبت و منفي وجود دارد و آن ها را
در يک ساختار بلورين به هم نگه مي دارد. اين پيوند ناشي از انتقال الکترون
بين اتم هاست. ترکيبات يوني متشکل از تعداد زيادي آنيون و کاتيون هستند که
با طرح معين هندسي در کنار هم قرار گرفتهاند و يک بلور بوجود مي آورند.
هر بلور، به سبب جاذبه هاي منفي ـ مثبت يون ها به هم، نگهداشته شده است.
فرمول شيميايي يک ترکيب يوني نشانه سادهترين نسبت يون هاي مختلف براي به
وجود آوردن بلوري است که از نظر الکتريکي خنثي باشد.
پيوند يوني IonicBond
ماهيت يون: وقتي اتمها به يون تبديل مي شوند، خواص آن ها شديدا تغيير مي کند. مثلا مجموعهاي از مولکول هاي برم قرمز است. اما يون هاي در رنگ بلور ماده مرکب هيچ دخالتي ندارند. يک قطعه سديم شامل اتمهاي سديم نرم است. خواص فلزي دارد و بر آب به شدت اثر مي کند. اما يون هاي در آب پايدارند. مجموعه بزرگي از مولکول هاي کلر، گازي سمّي بهرنگ زرد مايل به سبز است، ولي يون هاي کلريد مواد مرکب رنگ ايجاد نمي کنند و سمّي نيستند. به همين لحاظ است که يون هاي سديم و کلر را به صورت نمک طعام مي توان بدون ترس از واکنش شديد روي گوجه فرنگي ريخت. وقتي اتم ها به صورت يون در مي آيند، ماهيت آن ها آشکارا تغيير مي کند.
رسانايي الکتريکي: رسانايي الکتريکي مواد مرکب يوني مذاب به اين علت است که وقتي قطب هايي با بار مخالف در اين مواد مذاب قرار گيرد و ميدان الکتريکي برقرار شود، يون ها آزادانه به حرکت در مي آيند. اين حرکت يون ها بار يا جريان را از يک جا به جاي ديگر منتقل مي کنند. در جسم جامد که يون ها بي حرکتند و نمي توانند آزادانه حرکت کنند، جسم خاصيت رساناي الکتريکي ندارد.
سختي: سختي مواد مرکب يوني به علت پيوند محکم ميان يون هاي با بار مخالف است. براي پيوندهاي قوي انرژي بسياري لازم است تا يون ها از هم جدا شوند و امکان حرکت آزاد حالت مذاب را پيدا کنند. انرژي زياد به معني نقطه جوش بالا است که خود از ويژگي هاي مواد مرکب يوني است.
شکنندگي: مواد مرکب يوني شکنندهاند. زيرا که ساختار جامد آن ها آرايه منظمي از يون هاست. مثلا ساختار سديم کلريد(NaCl) را در نظر بگيريد. هر گاه يک سطح از يون ها فقط به فاصله يک يون در هر جهت جابجا شود، يون هايي که بار مشابه دارند درکنار يکديگر قرار مي گيرند و يکديگر را دفع مي کنند و چون جاذبهاي در کار نيست بلور مي شکند. سديم کلريد را نمي توان با چکش کاري، به ورقه هاي نازک تبديل کرد. با چنين عملي بلور نمک خرد و از هم پاشيده مي شود.
گروه هاي حاوي پيوند يوني
عناصرگروه IA(فلزات قليايي): يعنيLi ،Na ،Rb ، Cs، هر يک به ترتيب يک
الکترون بيشتر از گازهاي نجيب(He،Kr ،Ne ،Ar ، Xe) دارند. اگر هر يک از اين
فلزات از هر اتم يک الکترون از دست بدهند، جزء باقي مانده آرايش الکتروني
گاز نجيب متناظر خود را پيدا مي کند. مثلا، Li يک الکترون والانس در آرايش
حالت پايه دارد. از دست دادن يک الکترون موجب مي شود که Li ساختار
الکتروني He را پيدا کند. يک اتم Li که فقط دو الکترون و سه پروتون داشته
باشد، بار +1 خواهد داشت. يک اتم باردار مانند يا يک گروه از اتم هاي
باردار، مانند گروه سولفات را يون مي گويند.
عناصر گروه IIA(فلزات قليايي خاکي)
هر يک دو الکترون والانس دارند. پس براي اين کهmg ،ca ،sr ، ba ساختار گاز
نجيب را به دست آورند اتمهاي هرعنصر بايد دو الکترون از دست بدهند. از دست
رفتن دو الکترون موجب مي شود که دو پروتون در هسته خنثي نشده بماند. پس
هر يون بار +2 خواهد داشت. براي جدا شدن سومين الکترون لازم است جفت
الکترون هاي تراز اصلي با انرژي پايينتر شکسته شود. اين امر انرژي زيادتري
مي خواهد. جدا شدن الکترون ها از فلزات و تشکيل يون هاي مثبت حاصل از آن
ها را مي توان به راه هاي مختلف ترسيم کرد. پس جدا شدن يک الکترون از يک
اتم معين جداشدن الکترون هاي بعدي به ترتيب مشکل تر مي شود. زيرا با از
دست رفتن هر الکترون بار مؤثر زيادتري مي شود و الکترون هاي باقي مانده را
محکم تر نگاه مي دارد. بطور خلاصه يون هاي مثبت وقتي تشکيل مي شوند که
اتم هاي فلزي يک الکترون(گروهIA) دو الکترون (گروهIIA) و يا سه
الکترون(گروهIIIA) به اتمهاي غير فلزي مي دهند. يون هاي حاصل آرايش
الکتروني يکسان با يک گاز نجيب دارند.
عناصر گروه VIIA(هالوژن ها)
يون هاي مثبت در حضور يون هاي منفي پايدار مي شوند. خنثي شدن بار، هر دو نوع يون را پايدار مي کند. يون هاي منفي پايدار، از اتمهايي که شش يا هفت الکترون والانس دارند، توليد مي شوند. اين گونه اتمها آنقدر الکترون بدست مي آورند تا ساختار گاز نجيب را پيدا کنند. مثلا اتم هاي عناصر گروه VIIA(هالوژن ها) هفت الکترون والانس دارند و هر يک، يک الکترون مي خواهند تا آرايش الکتروني يک گاز نجيب را پيدا کنند. اگر اتمهايF ،Cl ،Br ، I هر يک، يک الکترون بدست آورند، يون هاي حاصل به ترتيب آرايش الکتروني را خواهند داشت.
عناص گروه VIA(گروه اکسيژن)
اتم عناصر(VIA) براي رسيدن به ساختار الکتروني يک گاز نجيب هريک دو
الکترون نياز دارند. اضافه شدن دو الکترون به هر اتم، سبب توليد مي شود.
روند به دست آوردن الکترون توسط غيرفلزات، مانند از دست دادن الکترون توسط
فلزات را مي توان به راه هاي متفاوت ترسيم کرد. بطور خلاصه غيرفلزات يک،
دو، يا سه الکترون از فلزات مي گيرند و يون منفي ايجاد مي کنند. اين يون
هاي منفي همگي الکترون هاي والانس جفت شده و آرايش هشت الکتروني پايدار
گازهاي نجيب را دارند.
فرمول شيميايي مواد مرکب يوني
فرمول شيميايي يک ماده مرکب از لحاظ الکتريکي خنثي است. خنثي بودن الکتريکي
مستلزم آن است که شمار بارهاي مثبت و منفي در بلور ماده مرکب برابر باشند.
دو براي هر، سه يون براي دو يون Al^3+ و الي آخر. در بلور نمک طعام يون
هاي با جاذبه الکتريکي ميان بارهاي مخالف، در جاي خود نگاه داشته شدهاند.
علاوه بر اين، براي خنثي بودن اين ماده مرکب بايد نسبت يون هاي سديم به يون
هاي کلريد 1 به 1 باشد. در اين صورت سادهترين فرمول آن خواهد بود. در
ساختار بلورين هر يون سديم با هر شش يون کلريد اطراف آن جذب مي شود. به
همين طريق هر يون کلريد با هر شش يون سديم اطراف آن جذب مي شود. در
ساختارهاي يوني هيچ مولکول تک اتمي وجود ندارد، يعني هيچ يون خاصي وجود
ندارد که منحصرا به يک يون ديگر بپيوندد.
|
مهم ترین نکات مربوط به پیوند کووالانسی به طور خلاصه:
دانش آموزان می توانند یک یا جند نکته را در یک فیش نوشته و به مرور مطالعه نمایند.برای یاد گیری بیشتر نکات حتما باید از تمرین های لازم استفاده شود.
1- از به اشتراک گذاشتن الکترون(ها) بین دو اتم نافلز،نیروی جاذبه ای ایجاد می شود که به آن پیوند کووالانسی گویند.
2- اگردو یا چند اتم باپیوند کووالانسی به هم متصل شوند،مولکول پدید می آید. ازتجمع مولکولها کنار هم ترکیبات مولکولی ایجاد می شود.
3- در هنگام تشکیل پیوند کووالانسی ،اثر نیروهای جاذبه بیشتر از دافعه است.
4- اتمهای تشکیل دهنده پیوند کووالانسی مانند فنر دائما در امتداد محور پیوند نوسان میکنند.
5- به فاصله تعادلی میان هسته های دو اتم درگیر پیوند،طول پیوند گویند.
6- به انرژی لازم برای شکستن پیوندکووالانسی انرژی پیوند گویند.
7- انرژی پیوند با طول پیوند رابطه عکس دارد.
8- اگر الکترونها بین دو اتم به طور یکنواخت پخش شوند ، آن پیوند را
کووالانسی ناقطبی،در غیر این صورت آن را پیوند کووالانسی قطبی گویند.
9- اتمی که الکترونگاتیوی زیادتری دارد قطب منفی و اتمی که
الکترونگاتیوی کمتری دارد ،قطب مثبت پیوند را تشکیل می دهد.
10- هرچه اختلاف الکترونگاتیوی دو اتم پیوند زیادتر باشد،پیوند قطبی تر
است.در این صورت اصطلاحا گویند خصلت یونی پیوند بیشتر است.
11- سمت اتم الکترونگاتیوتر جزئی منفی و سمت اتم دیگر جزئی مثبت است.
12- اگر 0 > اختلاف الکترونگاتیوی >0.4 باشد پیوند ناقطبی و اگر 0.4 ≥ اختلاف الکترونگاتیوی≥1.7 باشد پیوند قطبی و اگر اختلاف الکترونگاتیوی> 1.7 باشد پیوند یونی به حساب می آید.
13- در مدل الکترون نقطه ای نشانه شیمیایی هر عنصر نشان دهنده هسته و الکترون های درونی آن است و الکترون های لایه ظرفیتی به صورت نقطه در اطراف نشانه شیمیایی نمایش داده می شود.
14- به جفت الکترون های مشترک بین دو اتم ، جفت پیوندی و به الکترون هایی
که در تشکیل پیوند شرکت نمی کنند جفت های ناپیوندی گویند.
15- در پیوند کوولانسی ساده (یگانه) بین دو اتم تشکیل دهنده پیوند یک جفت الکترون به اشتراک گذاشته می شود. و در پیوند دوگانه دو جفت الکترون و در پیوند سه گانه سه جفت الکترون مشترک بین دو اتم وجود دارد. 16- در مولکول اوزون (O3) دو ساختار می توان رسم کرد که هر دو ساختار احتمال برابری دارند. در این مورد گویند مولکول واقعی هیچ یک از این
ساختارها را ندارد و فقط یک هیبرید رزونانسی از این ساختارهاست.
O O ≡ O O O O O O O
هیبرید رزونانسی ساختارهای رزونانسی
17-اندازه گیریها نشان می دهد که مولکول O3 طول پیوندهای یکسان دارد و
برابر میانگین طول پیوندهای یگانه و دو گانه است. و همچنین سطح انرژی
مولکول از سطح انرژی ساحتار لوویس کمتر است .این مطالب نشان می دهد که مولکول در حالت هیبریدی قرار دارد.
18- پیوند داتیو یا کوئوردینانسی کووالانسی پیوندی است که در آن الکترونهای
مشترک از طرف یک اتم تامین می شود. و اتم دیگر پذیرنده زوج الکترون است. 19- شرط تشکیل پیوند داتیو وجود زوج الکترون ناپیوندی در یک اتم و وجود اوربیتال خالی در اتم دیگر است.
20- نامگذاری به روش پیشوند: ابتدا تعداد اتم سمت چپ را با پیشوند یونانی و
بعد نام عنصر مربوطه و سپس تعداد و نام عنصر سمت راست(که الکترونگاتیوتر
است) را به( اید) ختم می کنیم . مانند : فسفر پنتا کلرید PCl5 - دی نیتروژن
تتراکسید N2O4
21- بار ظاهری نسبت داده شده به هر اتم را عدد اکسایش آن اتم گویند. که
نشان دهنده تعداد الکترون های گرفته شده و یا داده شده به اتم است.
22- عدد اکسایش عنصر به خالت آزاد مانند: Na-H2-F2 صفر است.
23- برای تعیین عدد اکسایش اتم هایی که در پیوند شرکت دارند ،فرض می
کنند عنصر الکترونگاتیوتر الکترون گرفته و عدد اکسایش منفی پیدا کرده و عنصر دیگر الکترون داده و عدد اکسایش مثبت پیدا کرده است .
24- عدد اکسایش یون های تک اتمی برابر بار یون است.
25- عدد اکسایش H اگر به اتمی با الکترونگاتیوی بیشتر از خود متصل با شد برابر 1+ و در غیر این صورت برابر 1- است.
26- عدد اکسایش O برابر 2- است به استثنائ OF2 که برابر 2+ و پر اکسیدها که برابر 1+ است.
27- در ترکیبات چندتایی ،جمع اعداد اکسایش اتم ها صفر است.
28- در یون های چندتایی جمع اعداد اکسایش اتمها برابر بار یون است.
29- بالاترین عدد اکسایش یک عنصر از شماره گروه اصلی آن بیشتر نیست. و
کمترین عدد اکسایش یک عنصر برابر تعداد الکترونی است که برای رسیدن به
آرایش هشتایی لازم دارد.
30 – فرمول تجربی : ساده ترین فرمول یک ترکیب است که شامل نشانه های شیمیایی عناصر آن با کمترین نسبتصحیص اتمها است.
31- فرمول مولکولی: نوع و تعداد واقعی اتم ها را در مولکول مشخص می کند.
و مضرب صحیحی از فرمول تجربی است.برای تعین این مضرب باید جرم مولی فرمول مولکولی را بر جرم مولی فرمول تجربی تقسیم کرد.
32- فرمول ساختاری: علاوه بر نوع و تعداد اتمها ی سازنده هر ترکیب، نحوه اتصال اتمها به همدیگر را نیز نشان می دهد.
33- ایزومر: ترکبیاتی که فرمول مولکولی یکسان ولی فرمول ساختاری مختلف دارند.
34- شکل هندسی مولکولها در تعیین خواص شیمیایی ترکیب موثر است و یکی از
نظریه هایی که شکل مولکول ها را اپیش بینی می کند ، نطریه " نیروی دافعه
جفت الکترون های ظرفیتی " است . بر اساس این نظریه نیروهای دافعه
موجود بین جفت الکترونهای پیوندی و ناپیوندی در مولکول سبب می شود که
این الکترون ها تا امکان دارد از هم دور شوند و پایدارترین آرایش را برای
مولکول فراهم کنند.
35- مولکول هایی که از سه اتم تشکیل شده اند و اتم مرکزی فاقد زوج آزاد
است آرایش خطی ( زاویه 180درجه) دارند. مانند: O=C=O , H-C≡N
36- مولکول هایی که از چهار اتم تشکیل شده اند و اتم مرکزی جفت آزاد
ندارد دارای ساختار سه ضلعی مسطح(زاویه پیوند 120 درجه) است. مانند: SO3 37- مولکول هایی که در اطراف اتم مرکزی آنها 4 اتم وجود داشته و فاقد زوج
آزاد هستند ، ساختار چهاروجهی دارند. ( زاویه پیوندی 109.5 درجه) مانند: CH4 , SiCl4
38- مولکول هایی که سه اتمی بوده و اتم مرکزی یک زوج آزاد دارد ساختار خمیده دارند. مانند H2O , SO2
|