هواکره
هواكره چيست؟
ما بر روي كره زمين و در كره اي از هوا زندگي م يكنيم. به همان شكل كه آبزيان دريا، دور تا دور آن ها را آب فرا گرفته...
محمد حسین خواجه سلیمی کلاس:۱۰۶
هواكره چيست؟
ما بر روي كره زمين و در كره اي از هوا زندگي م يكنيم. به همان شكل كه آبزيان دريا، دور تا دور آن ها را آب فرا گرفته...
محمد حسین خواجه سلیمی کلاس:۱۰۶
در سال 1895 ، درخشش کوتاه صفحه فسفرسانتی که در گوشهای از آزمایشگاه نیمه تاریک بررسی اشعه کاتدیک قرار داشت، ذهن آماده و خلاق رنتگن که در آن زمان استاد فیزیک بود، متوجه پرتوهای تازهای نمود که از حباب شیشهای لامپهای کاتودیک بیرون زده و بی آنکه به چشم دیده شود به اطراف پراکنده میشوند. آن چه مایه شگفتی رنتگسن شده بود، نفوذ این پرتوها از دیواره شیشهای لامپ به بیرون و تأثیر آن روی صفحه فاوئورسانت در گوشهای نسبتا دور از لامپ در آزمایشگاه بود. رنتگن به بررسیهای خود درباره کشف تازه که آن پرتو ایکس نامید (بخاطر فروتنی) ، ادامه داد. بعدها این اشعه رنتگن نامیده شد.
طیف اشعه ایکس
اشعه تولید شده بوسیله لامپ اشعه ایکس یک طول موج ندارد. بلکه شامل گسترهای از طول موجهاست. پرتوهای ایکس بوسیله دو نوع فرایند تولید میشوند:
پرتو حد پایینی طول موج طیف ، بیشترین اهمیت را در پرتو نگاری دارد. زیرا توانایی نفوذ آن بیشتر است.
مشخصههای بارز اشعه ایکس
بررسی کمی اشعه ایکس
نفوذ پذیری پرتوهای ایکس تولید شده از پرتوهای گاما کمتر بوده اما برای پرتوهای ایکس تولید شده در لامپهای اشعه ایکس بوسیله چشمههای پرانرژی در خصوص فولاد نیز دیده میشود. باید توجه کرد که بیشترین ضخامتهای استفاده از زمانهای پرتودهی چند دقیقهای و فیلمی با سرعت متوسط میتوان مورد بررسی قرار داد. مقاطع ضعیفتر را با استفاده از زمانهای پرتودهی طولانی و فیلمی با سرعت زیاد میتوان بازرسی کرد.
تولید اشعه ایکس
پرتوهای ایکس را بوسیله بمباران هدفی فلزی با باریکهای از الکترونهای سریع تولید می کنند. قطعات اصلی لامپ اشعه ایکس شامل کاتد برای گسیل الکترونها و آند به عنوان هدف میباشد، که هر دو درون لامپ خلا جای گرفتهاند. با توجه به میزان نفوذ اشعه ایکس و فرکانس مربوطهاش از لامپهای اشعه ایکس متنوعی در کارهای تحقیقاتی ، پزشکی ، صنعت و ... استفاده میکنند.
تهیه کننده : رضا زند مقدم کلاس ۲۰۲
مایکل فارادی (۲۲ سپتامبر ۱۷۹۱ - ۲۲ اوت ۱۸۶۷) دانشمندی (فیزیکدان و شیمیدان ) انگلیسی که با زمینههای الکترومغناطیس و الکتروشیمی مرتبط بود و یک حکیم مادی بود. وی چراغ بونزن را ابداع کرد.
فارادی درباره میدان مغناطیسی موجود در دور یک رسانا که جریان DC حمل میکند مطالعاتی داشت و مفاهیم اولیه میدان الکترومغناطیس را در فیزیک بنیان نهاد. وی القای الکترومغناطیسی و قانون های برقکافت را کشف کرد. او اثبات کرد که خاصیت مغناطیسی میتواند بر روی شعاع های نور اثر می گذارد و رابطهای اساسی بین این دو برقرار است.[۱][۲] اختراعات او در زمینه دستگاههای چرخنده الکترومغناطیس اساس فناوری موتور الکتریکی....
را پی ریزی کرد و این وضع ناشی از تلاشهای او در زمینه کاربرد الکتریسیته در فناوری بود
تهیه کننده/امین معصومی 201.
در اوایل، تلاش برای بیان طبیعت مواد و چگونگی دگرگونی آنها ناموفق بود. دانش پیشرفتهتر کیمیا نیز در این مورد ناتوان بود. به هرحال دانش کیمیا به کمک انجام تحقیقات اولیه و ثبت نتیجهها، پایهگذار شیمی مدرن بود. تغییر نگرش در شناخت مواد زمانی شروع شد که رابرت بویل در سال ۱۶۶۱ در کتاب شیمیدان شکاک میان شیمی و کیمیا تفاوت قائل شد.[۱][۲] پس از آن شیمی با تلاشهای آنتوان لاووازیه و ارائه قانون پایستگی جرم، به یک دانش تکاملیافته تبدیل شد. دغدغهٔ هر دو دانش کیمیا و شیمی شناخت طبیعت مواد و چگونگی دگرگونی آنها بود، اما تنها شیمی از شیوههای علمی قوی بهرهمند شد.[۲] با کوششهای ویژهٔ جوسایا ویلارد گیبز تاریخ شیمی با ترمودیناک رابطهٔ عمیقی پیدا کرد.[۳]
بسمه تعالی
نظریه اتمی
در این مقاله سعی داریم تا داستان تکامل نظریه اتمی و در نهایت نظریه های اتمی مدرن و تحقیقات انجام گرفته در این زمینه را به طور مختصر مورد بررسی قرار دهیم. که برای دانش آموزان و دانشجویان علاقمند به شیمی، فيزيك و مباحث مربوط به اتم مي تواند قابل بوده و همچنين براي افرادي كه در مورد تاريخچه كشف اتم مي خواهند به تحقيق به پردازند مورد استفاده قرار گيرد. در ضمن متذكر مي شود كه نويسنده مقاله در حال نگارش كتابي در همين زمينه مي باشد كه به طور مفصل به شرح تاريخچه اتم پرداخته و مي تواند مرجع كاملي در اين زمينه باشد.
- نظريه اتمي در عهد عتيق:
داستان اتم داراي فراز و نشيب هاي بسياري مي باشد كه دانستن آن بسيار جالب و آموزنده است. گفته مي شود براي اولين بار لوسيپوس leucippus ايده تشكيل مواد از ذرات بي نهايت ريز را مطرح ساخته است. او در شهر آبدرا در يونان نظريات خود را به ديگران آموزش مي داد. معتقد بود مواد را مي توان با بريدن، شكستن و... مي توان به ذرات كوچكتر و كوچكتري تقسيم نمود. ولي در يك جايي اين تقسيمات پايان مي يابد و به ذره اي مي رسيم كه ديگر قابل تقسيم نخواهد.
لوسيپوس شاگردي داشت به نام دموكريتوس كه به نظريه استاد علاقمند شده و سعي در گسترش آن نمود. وي سفرهاي بسياري نمود و رساله هاي زيادي نوشت،كه بر اثر مرور زمان رساله هايش از بين رفتند.
دموكريتوس Democritus كه حدود ۴۰۰ سال قبل از ميلاد مي زيست معتقد بود كه جهان از اتم و فضاي خالي تشكيل شده است و اتم ها ذرات غير قابل تجزيه هستند و تقسيم ناپذيرند. توجه شود كه اتم نام خود را نيز از همين تجزيه ناپذيريش كسب كرده است.(A علامت نفي بوده و tom به معناي قابل تجزيه مي باشد.)
نظريات لوسيپوس و دموكريتوس توسط افرادي چون اپيكوروس Epicurus و لوكريتوس Lucretius به آينده راه يافت به طوريكه ملاصدرا در ايران اقدام به تكميل نظريه اتمي و استفاده از ان در فلسفه و تمثيل نمود.
- بازگشت به نظريه اتمي در عصر جديد :
در سال ۱۷۸۰ ميلادي لاوازيه Lavoisier با كشف قانون بقاي جرم كه مي گفت : " جرم كلي مواد در واكنش شيميايي تغيير نمي يابد و جرم مواد اوليه با جرم محصولات برابر است." يك گام جديد در توسعه نظريه اتمي به پيش رفت.
در سال ۱۷۹۷ پروست Proust فرانسوي قانون نسبتهاي معين را پيشنهاد نمود كه مي گفت" در يك تركيب شيميايي نسبت وزني عناصر به يكديگر مقداري ثابت است." يعني 1 گرم هيدروژن با 8 گرم اكسيژن تركيب مي شود.
جان دالتون John Dalton معلم انگليسي در سال ۱۸۰۸ با استفاده از نظريات لاوزيه و پروست و همچنين مطالعه نظريات گذشتگان نظريه مدرن اتمي خود را به شرح زير بيان داشت:
۱- ماده از ذره هاي تجزيه ناپذيري به نام اتم تشكيل شده است.
۲- همه اتم هاي يك عنصر از لحاظ فعاليت هاي شيميايي مشابه يكديگرند.
۳- همه اتمهاي يك عنصر جرم هاي كاملاً يكسان دارند.
۴- اتمها نه به وجود مي آيند و نه از بين مي روند.
۵- اتم هاي عناصر مختلف به هم پيوسته و اتم هاي مركب به وجود مي آورند.
۶- در هر مولكول از يك تركيب معين، همواره نوع و تعداد اتمهاي سازنده يكسان است.
۷- واكنش هاي شيميايي شامل جا به جايي يا تغيير در شيوه اتصال آنهاست و اتمها طي اين واكنش ها تغييري نمي كنند.
محمد سعيد كلاس ۲۰۲
به نام خدا

مجمع عمومی ملل متحد قطعنامه نامگذاری سال 2011 با عنوان سال جهانی شیمی را تصویب کرد که بر اساس آن در این سال علاوه بر تاکید بر اهمیت شیمی در حفظ و پایداری منابع طبیعی، از فعالان این حوزه نیز قدردانی خواهد شد.
گرداورنده:سیدسجادخاکسار
مولکول ، دستهای از اتمهاست که با پیوندهای شیمیایی در کنار یکدیگر قرار گرفتهاند. مولکولهای یک عنصر ، یکسان و فقط حاوی اتمهای از یک نوع هستند...
گرداورنده:امیرمحمددایی زاده
عناصر مواد خالصی هستند که نمیتوان آنها را به دو ماده یا مواد بیشتر طوری تفکیک کرد که خاصیت مواد بدست آمده از ماده اصلی متفاوت باشد. بنابراین عنصر مادهای است که به مواد خالص سادهتر از خود تجزیه نمیشود...
گرداورنده:فردین کریم زاده
کلمه اتم از واژه یونانی Atomos به معنی (تقسیمناپذیر) گرفته شده است. اعتبار نخستین نظریه اتمی را بطور معمول از یونانیان باستان میدانند اما ممکن است خاستگاه این مفهوم در تمدنهای پیش از یونان باشد. نظریه اتمی (لوسیپوس) و (موکرتیس) که در قرن پنجم قبل از میلاد مسیح میزیستند مدعی آن است که تقسیم پیدرپی ماده در نهایت به اتمهایی میرسد که...
گرداورنده:محمدسالاری سعیدی
از نظر لغوی ، اوربیتال به معنای خانه الکترون میباشد و ناحیهای است که احتمال یافتن الکترون در آن زیاد است. معادله شرودینگر پایه مکانیک موجی است. این معادله...
گرداورنده:سیدسجادخاکسار
گاز ازن
مهدی فکرت
کلاس۱۰۱
در عمل فتوسنتز، کربن دی اکسید مصرف میشود و در عمل تنفس، موجود زنده اکسیژن را مصرف و کربن دی اکسید را تولید میکند بنابراین گاز تولید شده در هر فرآیند توسط فرآیند دیگر مصرف میشود.
نویسنده:محمد سجاد ساعدی کرمانی کلاس ۱۰۱
نویسنده:محمد سجاد ساعدی کرمانی کلاس ۱۰۱
آزمایش تامسون ( محاسبه نسبت بار به جرم الکترون ) 
در آزمایش تامسون از اثر میدان الکتریکی و میدان مغناطیسی استفاده شده است. دستگاهی که در این آزمایش مورد استفاده قرار گرفته است از قسمتهای زیر تشکیل شده است:
الف ) اطاق یونش که در حقیقت چشمه تهیه الکترون با سرعت معین می باشد بین کاتد و آند قرار گرفته است. در این قسمت در اثر تخلیه الکتریکی درون گاز ذرات کاتدی ( الکترون ) بوجود آمده بطرف قطب مثبت حرکت می کنند و با سرعت معینی از منفذی که روی آند تعبیه شده گذشته وارد قسمت دوم می شود. اگر بار الکتریکی q تحت تاثیر یک میدان الکتریکی بشدت E قرار گیرد، نیروییکه از طرف میدان بر این بار الکتریکی وارد می شود برابر است با:
تولد کوری
ماری کوری در سال 1867 با نام "ماریا اسکلو دووسکا" در ورشو پایتخت لهستان متولد شد.
آشنایی با پیر کوری
او در سن 19 سالگی به پاریس رفت تا در آنجا به تحصیل در رشته شیمی بپردازد. در آنجا با فیزیکدان جوان فرانسوی به نام پیر کوری آشنا شد. این آشنایی به ازدواج انجامید. او به پیر کوری در انجام آزمایشهای عملیاش درباره الکتریسیته کمک میکرد.
شروع فعالیت آزمایشگاهی ماری کوری
زمانی که ماری کوری در سال 1895 در انباری چوبی کوچکی که آزمایشگاه او بود شروع بکار کرد، نه او و نه هیچ کس دیگر چیزی در باره عنصر شیمیایی رادیم نمیدانست و این عنصر هنوز کشف نشده بود.
اوربيتال هاي وجودمان را
با الكترون هاي محبت پر كنيم
محمد سعيد كلاس ۲۰۲ رياضي فيزيك
آنچه در مورد شیمی باید بدانید:
آنچه در مورد شیمی باید بدانید
1- شیمی یک درس مفهومی است یا حفظی؟
تقسیم بندی درس ها به دو دسته ی حفظی و مفهومی به صورت مطلق کار درستی نیست. در مورد حفظی ترین درس ها هم تسلط بر مفاهیم آن درس، کمک می کند مطالب بهتر در حافظه بماند. به عبارت دیگر، پس از تسلط بر مفاهیم اصلی یک درس، به خاطرسپاری آنها ساده تر و ماندگاری آنها در حافظه بهتر صورت می گیرد.
در شیمی توصیه می شود قبل از به خاطرسپاری مطالب، مفاهیم اصلی را یاد بگیریم.
2- ضریب درس شیمی در کنکور چگونه است؟
شیمی یک درس اختصاصی است. در رشته ریاضی برای بسیاری از مهندسی ها مثل برق، مکانیک، هوا فضا، عمران، مواد، کامپیوتر و فنآوری اطلاعات و گرایش های رشته های انسانی مثل حقوق، مدیریت ها و علوم اقتصادی که داوطلبان ریاضی هم می توانند در آن شرکت کنند، ضریب 2 دارد اما در رشته های مهندسی شیمی، پلیمر و نفت و مهندسی ایمنی و حفاظت و گرایشهای مربوطه، ضریب 3 دارد.
در رشته تجربی برای رشته های پزشکی، دندانپزشکی و دامپزشکی و کل رشته های پیراپزشکی، صنایع غذایی، زیست شناسی، بیوتکنولوژی و گرایش های وابسته به آنها، ضریب 3 دارد. اما در رشته های شیمی محض و کاربردی و داروسازی، ضریب 4 دارد. در گرایش های انسانی مثل مدیریت ها و حقوق برای دانش آموزان رشته ی تجربی، ضریب 2 دارد.
از آن جا که درس شیمی در رشته ی ریاضی از نظر اهمیت در درجه ی سوم قرار دارد و به دلیل مطالب حفظی زیادی که دارد و دانش آموزان این رشته کمتربه آن اهمیت می دهند، دارای انحراف معیار بالایی در رشته ی ریاضی شده است.به طوری که دانش آموزانی که این درس را دقیق و مفهومی خوانده و برای آن وقت می گذارند موفق می شوند که در رتبه و تراز جهش بالایی داشته باشند.
محمد سعيد كلاس ۲۰۲ رياضي فيزيك
ادامه مطلب را ببینید تا بفهمید!

محمد سعید کلاس ۲۰۲ ریاضی فیزیک

پرتوزایی مصنوعی و شکاف هسته ای
پرتوزایی پدیده ای که کشف آن مسیر تازه ای را به روی بشر گشود و زندگی وی را تغییر داد. پرتوزایی پدیده ای است که تبدیلهای آن در هسته صورت می گیرد و به هسته مربوط می شود و مبحث اصلی شیمی هسته ای است.
محمد سعید کلاس۲۰۲ریاضی فیزیک

در سال ۱۹۲۴ یک فیزیکدان فرانسوی به نام لوییس دوبروی در مقاله اش با عنوان (تحقیق درباره ی نظریه ی کوانتوم) فرضیه ای را مطرح کرد که همه ی مواد دارای یک موج دوبروی می باشند که شبیه نور است.[۵۱] در شرایط مناسب، الکترون ها یا مواد دیگر ممکن است از خودشان ویژگی های ذرات یا امواج را نشان بدهند. ویژگی های ذره ای یک ذره هنگامی بروز می کنند که در هر لحظه از طول مسیرش از خود یک موقعیت متمرکز در فضا نشان بدهد.[۵۲] طبیعت موجی هنگامی مشاهده می شود که مثلاً وقتی یک پرتو نور از میان دو شکاف موازی عبور می کند و تشکیل طرح تداخلی می دهد. در سال ۱۹۲۷ اثر تداخلی با یک پرتو از الکترون ها و با استفاده از یک پرده نازک فلزی توسط یک فیزیکدان انگلیسی به نام جورج پاجت تامسون مشاهده شد و همچنین دو فیزیکدان آمریکایی به نام های کلینتون دیویسون و لستر گرمر این اثر را با استفاده از یک بلور نیکل مشاهده کردند.[۵۳]
محمد سعید کلاس ۲۰۲ ریاضی فیزیک

در سال ۱۹۱۴ آزمایش های انجام شده به وسیله ی فیزیکدانانی هم چون ارنست رادرفورد، هنری موزلی، جیمز فرانک و گوستاو هرتز تا حد زیادی ساختار یک اتم را مشخص کرده بود که بیان می کرد یک هسته ی متراکم با بار مثبت به وسیله ی الکترون هایی با جرم کم محاصره شده است.[۴۲] در سال ۱۹۱۳ یک فیزیکدان دانمارکی به نام نیلز بور فرض کرد که الکترون در حالت های انرژی کوانتیده، با انرژی تعیین شده به وسیله ی اندازه حرکت زاویه ای مدارهای الکترون به دور هسته قرار دارد. الکترون ها می توانند بین این حالت ها یا مدارها با نشر یا جذب فوتون ها در فرکانس های خاص، حرکت کنند. او به وسیله ی این مدارهای کوانتیده خطوط طیفی اتم هیدروژن را به طور دقیقی توضیح داد.[۴۳] با این وجود مدل بور در بیان علت شدت نسبی خطوط طیف شکست خورد و در توضیح طیف اتم های پیچیده تر ناموفق بود.[۴۲]
محمد سعید کلاس۲۰۲ ریاضی فیزیک

یونانیان باستان مشاهده کردند که وقتی کهربا با پشم مالش داده شود، اشیای کوچک را به سمت خود جذب می کند. اگر از صاعقه صرف نظر کنیم، این پدیده اولین تجربه ی مکتوب بشر از الکتریسیته است.[۱۳] در دهه ی ۱۶۰۰ دانشمندی انگلیسی به نام ویلیام گیلبرت در مقاله ای با عنوان مگنت برای اشاره به این ویژگی جذب اشیای کوچک پس از مالش، واژه ی لاتین جدیدی به نام الکتریکوس را به کار برد.[۱۴] واژه های الکتریسیته و الکتریک هر دو از واژه ی لاتین الکتروم ( هم چنین ریشه ی ترکیب همان اسم )، که از واژه ی یونانی ήλεκτρον (الکترون) برای کهربا آمده است، مشتق شده اند.
محمد سعید کلاس ۲۰۲ ریاضی فیزیک
|
الکترون | |
 تئوری وجود الکترون در هیدروژن | |
| ترکیب: | ذرات بنیادی اولیه |
|---|---|
| خانواده: | فرمیون |
| گروه: | لپتون |
| رده: | اول |
| برهمکنش: | جاذبه, الکترومغناطیس, نیروی ضعیف |
| پاد ذره بنیادی: | پوزیترون |
| استدلال: | G. Johnstone Stoney (۱۸۷۴) |
| کشف شده: | تامسون (۱۸۹۷) |
| نماد: | e−, β− |
| جرم: | ۹٫۱۰۹ ۳۸۲ ۱۵(۴۵) × ۱۰–۳۱ kg[۱] ۵٫۴۸۵ ۷۹۹ ۰۹(۲۷) × ۱۰–۴ u ۱⁄۱۸۲۲٫۸۸۸ ۴۸۴۳(۱۱) u |
| بار الکتریکی: | –۱٫۶۰۲ ۱۷۶ ۴۸۷(۴۰) × ۱۰–۱۹ C[۲] |
| اسپین: | ½ |


الکترون (به انگلیسی: Electron) یک ذره زیر اتمی است که حامل یک بار الکتریکی منفی می باشد. الکترون هیچ جزء یا ذره ی زیر مجموعه ی شناخته شده ای ندارد. بنابراین الکترون به طور کلی به عنوان یک ذره ی بنیادی شناخته می شود.[۳] یک الکترون دارای جرمی تقریباً برابر با۱۸۳۶/۱ جرم پروتون است.[۴][۵] اندازه حرکت زاویه ای ذاتی (اسپین) الکترون یک مقدار نیمه صحیح بر حسب ħ است، که به معنای آن است که الکترون یک فرمیون می باشد. پاد ذره ی الکترون پوزیترون نامیده می شود. پوزیترون همان الکترون است با این تفاوت که پوزیترون حامل بار الکتریکی با علامت مخالف بار الکتریکی الکترون است. هنگامی که یک الکترون با یک پوزیترون برخورد می کند، هردو ذره ممکن است پراکنده شوند و یا اینکه کاملاً نابود شوند، و یک جفت (یا بیشتر) فوتون های اشعه گاما تولید کنند. الکترون ها که متعلق به اولین نسل خانواده ی ذرات لپتون هستند،[۶] در واکنش های گرانشی، الکترومغناطیسی و واکنش های ضعیف شرکت می کنند.[۷] الکترون ها، همانند همه ی مواد، ویژگی های مکانیک کوانتومی مربوط به ذره و نیز موج را دارند، بنابراین آن ها می توانند با ذرات دیگر برخورد کنند و مانند نور دچار پراش شوند. هرچند به خوبی در آزمایش های انجام شده روی الکترون نشان داده می شود که دلیل این دوگانگی جرم بسیار کوچک الکترون است. از آنجاکه الکترون یک فرمیون است، طبق اصل طرد پاولی هیچ دو الکترونی نمی توانند یک حالت کوانتومی داشته باشند.[۶] مفهوم یک مقدار بار تجزیه ناپذیر برای توضیح ویژگی های شیمیایی اتم ها به عنوان یک نظریه در آمد و در سال ۱۸۳۸ توسط یک فیلسوف طبیعت گرای انگلیسی به نام ریچارد لامینگ مطرح شد;[۸] نام الکترون در سال ۱۸۹۴ توسط یک فیزیکدان ایرلندی به نام جورج جانتسون استونی برای این بار الکتریکی انتخاب شد. الکترون در سال ۱۸۹۷ توسط ج.ج. تامسون و گروهش که متشکل از فیزیکدانان انگلیسی بود، به عنوان یک ذره شناسایی شد.[۹][۱۰][۱۱]
محمد سعید کلاس ۲۰۲ریاضی فیزیک
حتما بخوانید برای من که خیلی جالب بود
جان دالتون:
| جان دالتون | |
|---|---|
 | |
| متولد | ۶ سپتامبر ۱۷۶۶ ایگلزفیلد, کامبرلند , |
| مرگ | ۲۷ ژوئیه ۱۸۴۴ منچستر , |
| رشته فعالیت | شیمی, فیزیک, هواشناسی |
| دانشجویان دکتری وی | جیمز پرسکات ژول |
| دلیل شهرت | کاشف تئوری اتم و الکترون کاشف بیماری کورنگی (دالتونیسم) |


جان دالتون شیمیدان و فیزیکدان بریتانیایی بود. معروفیت او بیشتر بخاطر پیشگامی او در نظریه اتمی است.
جان دالتون ۱۰ سال پیش از ثبت و اعلان استقلال آمریکا در سال ۱۷۶۶، در انگلستان زاده شد. خانواده او در یک کلبه کوچک گالی در روستایی زندگی میکردند. در کودکی، جان به همراه برادرش در یک مزرعه کار میکرد و در مغازه پدر در بافتن لباس او را یاری میدادند. با وجود فراهم بودن اندکی از لوازم اولیه زندگی آنها خانواده فقیری بودند، بسیاری از پسران فقیر در آن زمان از داشتن تحصیلات محروم بودند، اما جان توانست با خوششانسی در مدرسهای در همان نزدیک زادگاهش مشغول تحصیل شود. او به یادگیری علاقه زیادی نشان میداد. آموزگاران نیز او را به یادگیری تشویق میکردند. در ۱۲ سالگی، او اولین مدرسه خود را در شهری نزدیک محل اقامتش باز کرد اما به خاطر کمبود پول مجبور به بستن آنجا و کارکردن در مزرعه عمهاش شد.
عکس از نوجوانی جان دالتون برای بقیه داستان ادامه مطلب را انتخاب کنید
محمد سعید کلاس ۲۰۲ ریاضی فیزیک
ماریا اسکلودوسکا کوری (ماری کوری) (به لهستانی: Marie Skłodowska-Curie) (زاده ۷ نوامبر ۱۸۶۷ - درگذشته ۵ ژوئيه ۱۹۳۴) فیزیکدان و شیمیدان لهستانی بود. ماری کوری نخستین دانشمندی است که دوبار جایزهی نوبل را در رشتههای فیزیک و شیمی گرفت. وی در ۷ نوامبر سال ۱۸۶۷ در ورشو پایتخت لهستان متولد شد. در سال ۱۸۹۳ لیسانس خود را در رشته فیزیک دریافت کرد و تنها یک سال بعد در رشته ریاضیات نیز موفق به اخذ لیسانس گردید.
امیرضا دادبخش 203
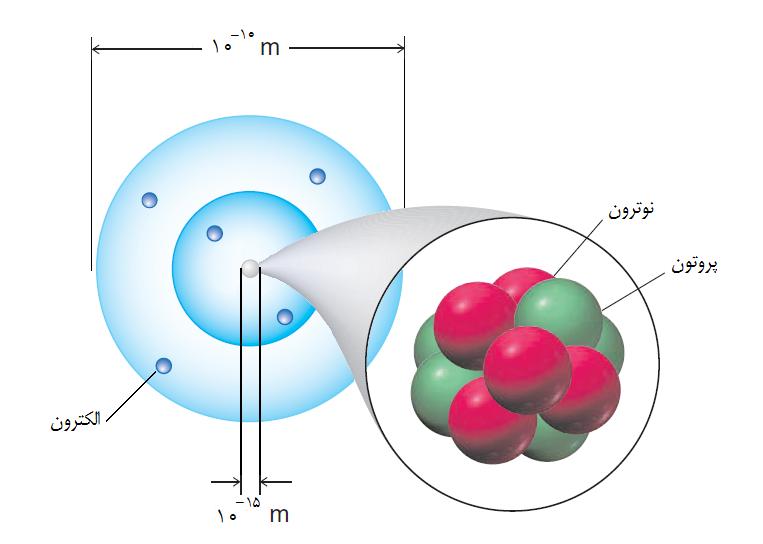 |
میتوان هسته اتم را به عنوان جرم نقطهای و بار آن را به صورت بار نقطهای در نظر گرفت. هسته شامل ، تمامی بارمثبت و تقریباً تمامی جرم اتم است، در نتیجه مرکزی تشکیل میدهد که حرکت الکترونی حول آن رخ میدهد. هر چند هسته عمدتاً از طریق نیروی جاذبه کلنی خود با الکترونها ساختار اتمی را تحت تأثیر قرار میدهد اما بعضی آثار نسبتاً دقیق را در طیفهای اتمی میتوان به آن نسبت داد.
برای اطلاعات بیشتر در موارد مختلف موضوعات زیر را انتخاب کنید:و برای ادامه موضوع ساختار اتم به ادامه مطلب بروید:
محمد سعید کلاس ۲۰۲